

http://dgep.uasnet.mx/quimica/images/practicas/cuaderno%20de%20qu%A1mica.doc
ELEMENTOS, COMPUESTOS Y MEZCLAS,
MÉTODOS DE SEPARACIÓN DE MEZCLAS
“JUNTOS PERO NO REVUELTOS”
MATERIAL :
2 g de azufre en polvo
2 g de sal
30 ml agua
2 vasos de precipitado
1 vidrio de reloj
1 embudo de filtración
1 papel filtro
PROCEDIMIENTO :
Observe las características físicas (color, olor y estado físico) de cada uno de las sustancias proporcionadas (azufre, sal de mesa y agua).
Mezcle el azufre y la sal en un vidrio de reloj hasta que quede una mezcla uniforme.
Coloque la mezcla en el vaso de precipitado y agregue un poco de agua, agite para homogenizar. Anote sus observaciones.
Filtre la mezcla empleando el embudo y el papel filtro, reciba el filtrado en el otro vaso de precipitado.
Observa el producto obtenido en el papel filtro y registra sus características ¿qué es?
¿Qué parte de la mezcla se disolvió? ¿cómo podrías separarlo del agua?
EXPLICACIÓN :
Las sustancias químicas por su composición se pueden clasificar en elementos, compuestos o mezclas.
El azufre (S) es un elemento formado por la unión de átomos del mismo tipo.
La sal de mesa o cloruro de sodio (NaCl), al igual que el agua (H2O), se encuentran clasificados en el grupo de los compuestos ya que su composición consta de átomos de diferente tipo. Sodio (Na) y cloro (Cl) e hidrógeno (H2) y oxígeno (O2) respectivamente.
Al unir el S, el NaCl y el H2O se forma una mezcla, es decir, la unión física de 3 sustancias diferentes que conservan sus características químicas y que son posibles de separar por métodos físicos.
La sal se disuelve en el agua y pasa a través del papel filtro con ésta, por lo que es posible separar el azufre de la mezcla y observar que conserva sus propiedades originales.

MEZCLAS, SOLUCIONES
“UNIDOS O SEPARADOS”
MATERIAL:
2 vasos de vidrio
1 embudo
2 papeles filtro
Sal
Arena o harina
Agua
PROCEDIMIENTO:
Coloque agua hasta ¾ partes de los dos vasos. Añada a uno una cucharadita de sal y al otro una cucharadita de arena o harina, agite. Observe y describa cada uno:
Filtre ambas soluciones y anote sus observaciones.
EXPLICACIÓN:
Una suspensión en una mezcla heterogénea en la que se observan varias fases, sus componentes pueden separarse por filtración o si se deja en reposo, el soluto se sedimenta o flota.
Cuando un líquido es soluble en otro por ejemplo el agua y el alcohol, se dice que son miscibles. Los líquidos que no se mezclan entre sí como el agua y el aceite son inmiscibles. En ocasiones necesitamos que dos líquidos no miscibles, se mezclen lo más homogéneamente posible, por ejemplo, cuando se prepara un aderezo de una ensalada se mezcla el vinagre (que tiene agua), el aceite y la sal en un recipiente y se agita muy bien para que quede muy bien repartido.
¿Qué sucede al agitar?
Mientras más bien se agite la mezcla, más pequeñas son las gotas y se tardan más tiempo en separarse del agua. Existen mezclas que no se sedimentan como las suspensiones a estas mezclas se les llama coloides.
MEZCLAS, COLOIDES
“COMBUSTIBLE SÓLIDO”
MATERIALES:
1 probeta graduada
2 vasos de precipitado de 250 ml
3.5 gr de acetato de calcio, Ca (CH3COO)2
Agua tibia destilada
30 ml de alcohol etílico absoluto
gotero con colorante vegetal
PROCEDIMIENTO:
En el vaso de precipitado prepare una solución saturada de acetato de calcio disolviendo 3.5 gr del mismo en 10 ml de agua caliente. En otro vaso agregue 30 ml de alcohol etílico, mezcle ambas soluciones.
Para que el gel sea colorido agregue una gota de colorante vegetal al alcohol.
Si el gel no se forma inmediatamente agregue más solución saturada de acetato de calcio.
Se coloca un poco de gel en una tapa metálica, misma que al ser encendida produce una flama muy pálida e incolora pero el color es muy intenso. Guarde el gel a un frasco de vidrio.
ALCOHOL + ACETATO DE CALCIO GEL
EXPLICACIÓN:
Esta actividad nos ayuda a explorar o conocer las ideas previas que poseen nuestros alumnos, con respecto a los siguientes conceptos: mezcla, tipos de mezclas, disolución, suspensión, coloide, reacción endotérmica y exotérmica. Pretende además, que nuestros alumnos se motiven al elaborar un producto que pueda ser utilizado como fuente de calor en aquellos momentos especiales.
¿Cómo se explica la formación de este gel sólido?
El acetato de calcio probablemente forma un sistema coloidal que mantiene suspendidas o dispersas a las moléculas de alcohol etílico.
http://tbn0.google.com/images?q=tbn:UXGklZLOW9o98M:http://www.cneq.unam.mx
MEZCLAS, COLOIDES, EFECTO TYNDALL
“LA CARTULINA QUE ILUMINA”
MATERIAL:
Clara de huevo
Refresco de fruta
Almíbar
Agua con sal
Agua con azúcar
5 vasos de vidrio
Linterna pequeña y potente
Cartulina negra
PROCEDIMIENTO:
Los vasos bien limpios, llénelos con los diferentes líquidos. Ponga la cartulina negra como fondo e ilumine con la linterna y obsérvelos.
¿Cómo se ve la cartulina?
Clasifique los líquidos en soluciones y coloides.
EXPLICACIÓN:
El rayo de luz pasa a través de una solución sin dispersarse, pero el rayo se dispersa cuando pasa a través de un coloide.
Los coloides son mezclas de dos fases de materia. Sus partículas son más grandes que en las soluciones, pero más chicas que en una suspensión, no pueden verse ni en el microscopio más potente. Son mezclas estables que no se separan espontáneamente.
MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS,
CAMBIO FÍSICO
"ENTRE MEZCLAS"
MATERIAL:
1 tubo de ensaye de 16 x 150 mm
1 colorante vegetal
Agua
Aceite comestible
PROCEDIMIENTO:
En un tubo de ensayo agregue la mitad de agua y una gota de colorante vegetal y agite. Después de agitar, agregue aceite comestible en el mismo tubo y observe.
La disolución del colorante en el agua es un fenómeno ¿Físico o químico? ¿El agregar aceite al agua constituye un fenómeno físico o químico?
La mezcla de colorante y agua es un sistema ¿Homogéneo o heterogéneo? ¿Y la mezcla de agua con el aceite?
EXPLICACIÓN:
La unión del colorante y agua es un fenómeno físico porque tanto el colorante como el agua antes y después del proceso conservan sus propiedades físicas y químicas. Esta unión se caracteriza por ser una mezcla homogénea.
En el caso del agua y el aceite es más evidente que se trata de un fenómeno físico ya que ambas sustancias coexisten de manera independiente conservando todas sus propiedades sin cambio alguno, lo que se conoce como mezcla heterogénea.
MÉTODOS DE SEPARACIÓN DE MEZCLAS (DESTILACIÓN)
“VIBRANDO, SALTANDO Y ESCAPANDO”
MATERIALES:
Personal humano
Gis
PROCEDIMIENTO:
Se acomodan los alumnos alrededor del aula, posteriormente se procede a dibujar en el centro del aula un equipo de destilación, de forma tal que permita la movilidad de aproximadamente 14 de ellos.
Se eligen a catorce alumnos, de los cuales cinco sean mujeres, quienes representarán al agua dentro del matraz; cuatro hombres representarán al éter etílico; tres, la acetona y dos, el jabón.
Se interroga a los alumnos sobre los puntos de ebullición de las sustancias antes mencionadas, se les informa que los residuos de jabón son sólidos y que poseen un punto de ebullición alto.
A continuación cada subgrupo de alumnos procede a actuar y relatar con voz lo suficientemente fuerte para que sea escuchada por todo el grupo:
Narración del equipo que representa al agua:
“Soy el agua, soy un líquido muy preciado por el hombre, presento simpatías con muchas de las sustancias que hay en la tierra. Por esto, si me agregan algo de sal común(cloruro de sodio), luego la cubro y hago que pierda algunas propiedades físicas como es su estado sólido. Poseo cargas negativa y positiva en los extremos de mi molécula, por lo tanto mi molécula es polar y tengo la capacidad de atraer a mis compañeros más cercanos. Por ello mi parte negativa atrae a la parte positiva del sodio de la sal común”.
Narración del éter y la acetona:
“Somos el éter y la acetona, nos dicen que somos moléculas hidrofílicas porque en griego significa que amamos el agua, presentamos atracción por ella, esto es, nos “perdemos entre sus moléculas”.
“Cuando aumenta la temperatura todos nosotros sentimos que nuestras moléculas se excitan, se incrementa el movimiento de vibración, incluso podemos desplazarnos de un lugar a otro, como está sucediendo en estos momentos que empezamos a sentir un poco más de calor. Siento calor, mucho calor, como en otras ocasiones, pero no el suficiente como para poder desplazarme por todo el recipiente”.
Narración del éter:
“El éter lo escucha y le dice: pero yo que soy sensible al calor, creo que si mis cálculos no me engañan, la temperatura debe estar cerca de los 30 ºC y como mi punto de ebullición es de 34ºC, el calor aumenta, presiento que ya es hora de irme, de desplazarme, dejar este encierro, quiero expandirme en el universo, ser parte de él, ojalá y no me vuelvan a cambiar de estado, me gusta más el gaseoso. Adiós compañeros, ¡acetona!, ¡agua!, !jabón!, llegó la hora de partir”.
Narración de la acetona:
“No te preocupes luego te alcanzo, si no lo sabes, mi estructura me permite tener propiedades físicas cercanas a la tuyas. Por si no lo recuerdas, somos primos hermanos, así que luego te alcanzo; ya empiezo a tener más movimiento. Si esto es así, la temperatura debe estar acercándose a los 50 ºC y mi punto de ebullición es de 56 ºC.
Narración del agua:
Así mero, yo apenas siento un sabroso calor ¡Estoy caliente! pero aun no hiervo de ganas para salir a buscar quién me quiera.
Narración de la acetona:
¡Ah! que calor, ahora sí me llegó la hora de partir. ¡Yo!, ya no podré en mi siguiente estado limpiar más esmaltes de uñas, ¡nos vemos pronto! Ahí los dejo con su compañero el jabón Ariel o no sé cuál, lo que sí sé es que juntos son ustedes también muy queridos; no obstante, su abuso ha hecho daño a la vida, a la naturaleza, por ello ¡No te vanaglories amigo jabón! Muévete con cuidado y sin malicia, recuerda que ¡No nada más con jabón, se quitan las manchas!
Narración del agua:
¡Ah! ¡Ah! que calorcito, parece que ahora sí me llego la hora. De seguro la temperatura está por encima de los noventa ªC, mi estructura vibra como coche desafinado, ni modo amigo jabón, yo también me voy, lo siento porque te quedas solo, pero no te preocupes, ya alguien te necesitará y vendrá por ti.
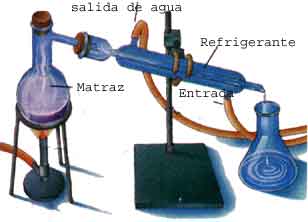
EXPLICACIÓN:
Se busca con este tipo de prácticas, incentivar al grupo hacia una mayor comunicación e interacción. Que a través de una actividad lúdica, el alumno comprenda el proceso de destilación y el comportamiento que presentan las moléculas con el aumento de la temperatura.

No hay comentarios:
Publicar un comentario