Conceptos(Saber)
Mezcla
Mezcla homogénea
Mezcla heterogénea
Fase
Sustancias
Métodos de separación de mezclas:
filtración, sedimentación, decantación, sublimación ,evaporación, extracción, centrifugación, cromatografía, tamizado, destilación,cristalización.
Procedimientos (Saber hacer) Los alumnos:
En el laboratorio se formarán mezclas homogéneas (agua con colorante, agua con azúcar y saborizante)
Formación de mezclas heterogéneas (agua y aceite,etc.
Los alumnos realizarán un reporte con los datos recopilados
Elaborarán una tabla de diferencias entre las mezclas homogéneas y heterogéneas
Actitudes (Ser)
Flexibilidad
Curiosidad
Respeto (ideas y valores)
Capacidad de iniciativa y confianza
Atención e interés.
Disposición al trabajo
Trabajo en equipo
Trabajo ordenado y limpio
Objetivos didácticos/ de aprendizaje:
El aprendizaje se dará basado en proyectos, pues como trabajo final deberán preparar una nieve, mayonesa, ensalada, etc para concretar el trabajo de mezclas. y reconoceran los procesos de separación de mezclas
http://www.cneq.unam.mx/cursos_diplomados/diplomados/medio_superior/dgire2006-2007/11_porta/mezclas/index.htm
1.Identificar a las mezclas en la vida cotidiana.
2.Diferenciar los tipos de mezclas.
3.Conocer algunas técnicas de separación o concentración de mezclas.
4.Analizar la importancia de las mezclas en la elaboración de productos de uso cotidiano.
5.Reflexionar sobre la aplicación de los métodos de separación de mezclas en beneficio del ser humano y del medio ambiente.
ACTIVIDADES
Identificación y manejo de ideas/ conocimientos previos e intereses del alumno respecto al tema:
Cuestionario sobre mezclas y separación de mezclas
Actividades de enseñanza/ aprendizaje
Tiempos y
Espacios
Manejo del Grupo/
equipos
Estrategias
Materiales y
recursos tecnológicos
1.
2.
3.
4.
5.
6.
7.
8.
9.
PROCESO
Extensión temporal de la unidad y condiciones de aplicación previstas:
EVALUACIÓN DEL APRENDIZAJE DEL ALUMNO
Actividades/instrumentos para la evaluación inicial:
Estrategias/instrumentos de evaluación formativa:
Estrategias, instrumentos e informe de la evaluación sumativa y la autoevaluación del aprendizaje:
EVALUACIÓN DE LA SD
Grado de motivación y participación:
Valoración del profesor(a):
Valoración del grupo:
Grado de adecuación al grupo:
Valoración global final:
El seguimiento del diseño de la SD en el grupo se realizará en un blog (bitácora electrónica)
Comentarios/Sugerencias:
LOS MEZCLADOS
Integrantes del equipo: De izquierda a derecha. Profr. Federico Castro, Ing. Geofísico,egresado del IPN; Profra. Patricia Campos, Q.F.B. egresada de la Fac. de Quimica de la UNAM; Profr. Epifanio Quiroz, Biólogo egresado de la Facultad de Ciencias UNAM; Profra. Nohemí Gómez egresada de la Escuela Normal Superior en la especialidad de Química;Profr. Ricardo Valdez, Biólogo egresado de la Facultad de Ciencias UNAM; y el Profr. Ricardo Martín Galindo egresado del CBTIS #78 en la especialidad de Análisis Clínicos
lunes, 5 de enero de 2009
Recordemos el tema del blog elaborando éste rico chocolate.

Actividades y estrategias de motivación y colaboración: Los alumnos (as) pueden preparar diferentes mezclas, por ejemplo una bebida de chocolate caliente.
Cómo preparar chocolate caliente http://es.wikihow.com/preparar-chocolate-caliente
El chocolate caliente es una vieja tradición en los hogares hispanos, desde que se exportó de América a Europa el cacao. El tiempo de preparación es de 20 minutos como mucho.
Pasos
Escoger una marca de chocolate oscuro endulzado o amargo.
Cortar dos pedazos y echarlos en una cacerola mediana con una taza de agua. Añadir una pizca de canela molida y dejar que hierva revolviendo con una cuchara de madera.
Abrir una lata de leche evaporada (puede ser de la variedad libre de grasa), añadirla toda de una vez a la mezcla de agua y chocolate.
Mientras la leche y el chocolate se cuecen, preparar una taza de agua templada y añadirle una cucharada repleta de fécula de maiz o maicena, revolviendo bien para que se disuelva. Cuando el chocolate llegue al punto de hervor, añadirle la taza de agua con maicena y revolver con la cuchara de madera hasta que espese. Si el chocolate empieza a subir o aumentar de volumen, retirar del fuego. Preparar la chocolatera con un poco de vainilla o brandy para perfumar el chocolate, vertirlo, revolverlo y servirlo.
Consejos
Si el chocolate es dulce, probarlo cuando le añada la leche a ver si está bien de dulzor. Si el chocolate es sin azúcar, añadir al agua de 2 a 4 cucharadas de azúcar refinada, blanca. También puede usar endulcorante artificial, aunque algunos como la marca Splenda® resisten el calor. El aspartame no se puede hervir.
Los norteamericanos adornan el chocolate con malvaviscos pequeños flotando en su superficie. Otras personas le añaden crema batida o Chantillí por encima y espolvorean con canela molida o chocolate rallado. Sea creativo.
Cosas que necesitará
Chocolate oscuro amargo o endulzado.
Canela molida.
Una cuchara de madera.
Agua.
Leche evaporada
Fécula de maíz o maicena.
Vainilla o brandy
Malvaviscos, crema batida, chantilly o canela. (opcional, para adorno)
http://upload.wikimedia.org/wikipedia/commons/1/18/Hot_chocolate.jpg
TEMA(S): MÉTODOS DE SEPARACIÓN DE MEZCLAS (CROMATOGRAFÍA)
"SEPARANDO COLORES"

MATERIAL:
1 plumón de agua de tinta verde
1 vaso de precipitado de 50 ml
1 gotero
1 papel filtro
20 ml de alcohol de caña comercial
PROCEDIMIENTO:
Con un plumón de tinta verde, haga un punto grueso en el centro de un papel filtro.
Ponga el papel filtro sobre un vaso de precipitado de 50 ml y con la ayuda de un gotero deje caer una gota de alcohol sobre el punto verde. Deje que se absorba el alcohol, después deje caer otra gota de alcohol. Agregue así muchas gotas de alcohol sobre el centro del papel filtro, teniendo cuidado de que la gota antecedente haya sido absorbida por el papel.
Al cabo de algunos instantes, verá aparecer aureolas concéntricas azules y después amarillas ¿A qué se debe esto?
¿Que habría sucedido si en vez de plumón verde hubiese utilizado plumón negro?
EXPLICACIÓN:
El color verde es la mezcla de dos pigmentos: azul y amarillo. Por lo que al colocarlo sobre una superficie porosa como lo es el papel filtro y agregarle alcohol, los pigmentos son arrastrados a diferentes velocidades, dado sus diferentes tamaños de partícula, ocasionando con esto la formación de dos aureolas concéntricas, una de azul y otra de amarillo. A esta técnica de separación se le conoce como cromatografía.
Si esta técnica se le practicara al color negro se obtendría una gran cantidad de colores, ya que éste es una mezcla de varios colores.
La técnica de cromatografía se emplea además en el análisis y separación de mezclas de otras sustancias químicas basándose en el tamaño de las partículas.
MÉTODOS DE SEPARACIÓN DE MEZCLAS, CAMPO MAGNÉTICO
 “EL DIVORCIO”
“EL DIVORCIO”
MATERIAL :
10 gr de limadura de hierro (Fe)
10 gr de aserrín
1 imán de herradura
2 hojas de papel
PROCEDIMIENTO:
Sobre una hoja de papel coloque la limadura de hierro y el aserrín, tome el imán de herradura y frótelo con una hoja de papel, posteriormente pase repetidas veces el imán sobre la mezcla de hierro y aserrín. Retire el papel del imán para recuperar el hierro.
EXPLICACIÓN:
El hierro, que es un metal, es atraído por el campo magnético del imán, por lo que es posible separarlo del aserrín.
Actividad 29
TEMA(S) : MÉTODOS DE SEPARACIÓN DE MEZCLAS
DIÁLISIS, DISOLUCIÓN, COLOIDES,
“EL SALVAVIDAS “
MATERIAL:
1 bolsa de celofán
250 ml de agua
2 gr de sal
2 gr de almidón
25 cm de hilo
1 recipiente de cristal (vaso)
PROCEDIMIENTO:
Coloca la sal y el almidón en la bolsa de celofán anudada con el cordel e introdúzcala al vaso con agua, agítela y pruebe el agua ¿Qué sucede?

EXPLICACIÓN:
La bolsa de celofán es una membrana que impide la salida del almidón (coloide), pero permite la de la sal (disolución). El agua sale salada, pero no lleva almidón. Lo mismo sucede en el riñón. Pueden salir solutos, pero no coloides (como proteínas, por ejemplo). El tamaño de los poros del papel filtro es 1000 veces mayor que el del celofán o las membranas renales.
"SEPARANDO COLORES"
MATERIAL:
1 plumón de agua de tinta verde
1 vaso de precipitado de 50 ml
1 gotero
1 papel filtro
20 ml de alcohol de caña comercial
PROCEDIMIENTO:
Con un plumón de tinta verde, haga un punto grueso en el centro de un papel filtro.
Ponga el papel filtro sobre un vaso de precipitado de 50 ml y con la ayuda de un gotero deje caer una gota de alcohol sobre el punto verde. Deje que se absorba el alcohol, después deje caer otra gota de alcohol. Agregue así muchas gotas de alcohol sobre el centro del papel filtro, teniendo cuidado de que la gota antecedente haya sido absorbida por el papel.
Al cabo de algunos instantes, verá aparecer aureolas concéntricas azules y después amarillas ¿A qué se debe esto?
¿Que habría sucedido si en vez de plumón verde hubiese utilizado plumón negro?
EXPLICACIÓN:
El color verde es la mezcla de dos pigmentos: azul y amarillo. Por lo que al colocarlo sobre una superficie porosa como lo es el papel filtro y agregarle alcohol, los pigmentos son arrastrados a diferentes velocidades, dado sus diferentes tamaños de partícula, ocasionando con esto la formación de dos aureolas concéntricas, una de azul y otra de amarillo. A esta técnica de separación se le conoce como cromatografía.
Si esta técnica se le practicara al color negro se obtendría una gran cantidad de colores, ya que éste es una mezcla de varios colores.
La técnica de cromatografía se emplea además en el análisis y separación de mezclas de otras sustancias químicas basándose en el tamaño de las partículas.
MÉTODOS DE SEPARACIÓN DE MEZCLAS, CAMPO MAGNÉTICO
 “EL DIVORCIO”
“EL DIVORCIO”MATERIAL :
10 gr de limadura de hierro (Fe)
10 gr de aserrín
1 imán de herradura
2 hojas de papel
PROCEDIMIENTO:
Sobre una hoja de papel coloque la limadura de hierro y el aserrín, tome el imán de herradura y frótelo con una hoja de papel, posteriormente pase repetidas veces el imán sobre la mezcla de hierro y aserrín. Retire el papel del imán para recuperar el hierro.
EXPLICACIÓN:
El hierro, que es un metal, es atraído por el campo magnético del imán, por lo que es posible separarlo del aserrín.
Actividad 29
TEMA(S) : MÉTODOS DE SEPARACIÓN DE MEZCLAS
DIÁLISIS, DISOLUCIÓN, COLOIDES,
“EL SALVAVIDAS “
MATERIAL:
1 bolsa de celofán
250 ml de agua
2 gr de sal
2 gr de almidón
25 cm de hilo
1 recipiente de cristal (vaso)
PROCEDIMIENTO:
Coloca la sal y el almidón en la bolsa de celofán anudada con el cordel e introdúzcala al vaso con agua, agítela y pruebe el agua ¿Qué sucede?

EXPLICACIÓN:
La bolsa de celofán es una membrana que impide la salida del almidón (coloide), pero permite la de la sal (disolución). El agua sale salada, pero no lleva almidón. Lo mismo sucede en el riñón. Pueden salir solutos, pero no coloides (como proteínas, por ejemplo). El tamaño de los poros del papel filtro es 1000 veces mayor que el del celofán o las membranas renales.
domingo, 4 de enero de 2009
Y AHORA ALGUNAS ACTIVIDADES PARA SEPARAR MEZCLAS


http://dgep.uasnet.mx/quimica/images/practicas/cuaderno%20de%20qu%A1mica.doc
ELEMENTOS, COMPUESTOS Y MEZCLAS,
MÉTODOS DE SEPARACIÓN DE MEZCLAS
“JUNTOS PERO NO REVUELTOS”
MATERIAL :
2 g de azufre en polvo
2 g de sal
30 ml agua
2 vasos de precipitado
1 vidrio de reloj
1 embudo de filtración
1 papel filtro
PROCEDIMIENTO :
Observe las características físicas (color, olor y estado físico) de cada uno de las sustancias proporcionadas (azufre, sal de mesa y agua).
Mezcle el azufre y la sal en un vidrio de reloj hasta que quede una mezcla uniforme.
Coloque la mezcla en el vaso de precipitado y agregue un poco de agua, agite para homogenizar. Anote sus observaciones.
Filtre la mezcla empleando el embudo y el papel filtro, reciba el filtrado en el otro vaso de precipitado.
Observa el producto obtenido en el papel filtro y registra sus características ¿qué es?
¿Qué parte de la mezcla se disolvió? ¿cómo podrías separarlo del agua?
EXPLICACIÓN :
Las sustancias químicas por su composición se pueden clasificar en elementos, compuestos o mezclas.
El azufre (S) es un elemento formado por la unión de átomos del mismo tipo.
La sal de mesa o cloruro de sodio (NaCl), al igual que el agua (H2O), se encuentran clasificados en el grupo de los compuestos ya que su composición consta de átomos de diferente tipo. Sodio (Na) y cloro (Cl) e hidrógeno (H2) y oxígeno (O2) respectivamente.
Al unir el S, el NaCl y el H2O se forma una mezcla, es decir, la unión física de 3 sustancias diferentes que conservan sus características químicas y que son posibles de separar por métodos físicos.
La sal se disuelve en el agua y pasa a través del papel filtro con ésta, por lo que es posible separar el azufre de la mezcla y observar que conserva sus propiedades originales.

MEZCLAS, SOLUCIONES
“UNIDOS O SEPARADOS”
MATERIAL:
2 vasos de vidrio
1 embudo
2 papeles filtro
Sal
Arena o harina
Agua
PROCEDIMIENTO:
Coloque agua hasta ¾ partes de los dos vasos. Añada a uno una cucharadita de sal y al otro una cucharadita de arena o harina, agite. Observe y describa cada uno:
Filtre ambas soluciones y anote sus observaciones.
EXPLICACIÓN:
Una suspensión en una mezcla heterogénea en la que se observan varias fases, sus componentes pueden separarse por filtración o si se deja en reposo, el soluto se sedimenta o flota.
Cuando un líquido es soluble en otro por ejemplo el agua y el alcohol, se dice que son miscibles. Los líquidos que no se mezclan entre sí como el agua y el aceite son inmiscibles. En ocasiones necesitamos que dos líquidos no miscibles, se mezclen lo más homogéneamente posible, por ejemplo, cuando se prepara un aderezo de una ensalada se mezcla el vinagre (que tiene agua), el aceite y la sal en un recipiente y se agita muy bien para que quede muy bien repartido.
¿Qué sucede al agitar?
Mientras más bien se agite la mezcla, más pequeñas son las gotas y se tardan más tiempo en separarse del agua. Existen mezclas que no se sedimentan como las suspensiones a estas mezclas se les llama coloides.
MEZCLAS, COLOIDES
“COMBUSTIBLE SÓLIDO”
MATERIALES:
1 probeta graduada
2 vasos de precipitado de 250 ml
3.5 gr de acetato de calcio, Ca (CH3COO)2
Agua tibia destilada
30 ml de alcohol etílico absoluto
gotero con colorante vegetal
PROCEDIMIENTO:
En el vaso de precipitado prepare una solución saturada de acetato de calcio disolviendo 3.5 gr del mismo en 10 ml de agua caliente. En otro vaso agregue 30 ml de alcohol etílico, mezcle ambas soluciones.
Para que el gel sea colorido agregue una gota de colorante vegetal al alcohol.
Si el gel no se forma inmediatamente agregue más solución saturada de acetato de calcio.
Se coloca un poco de gel en una tapa metálica, misma que al ser encendida produce una flama muy pálida e incolora pero el color es muy intenso. Guarde el gel a un frasco de vidrio.
ALCOHOL + ACETATO DE CALCIO GEL
EXPLICACIÓN:
Esta actividad nos ayuda a explorar o conocer las ideas previas que poseen nuestros alumnos, con respecto a los siguientes conceptos: mezcla, tipos de mezclas, disolución, suspensión, coloide, reacción endotérmica y exotérmica. Pretende además, que nuestros alumnos se motiven al elaborar un producto que pueda ser utilizado como fuente de calor en aquellos momentos especiales.
¿Cómo se explica la formación de este gel sólido?
El acetato de calcio probablemente forma un sistema coloidal que mantiene suspendidas o dispersas a las moléculas de alcohol etílico.
http://tbn0.google.com/images?q=tbn:UXGklZLOW9o98M:http://www.cneq.unam.mx
MEZCLAS, COLOIDES, EFECTO TYNDALL
“LA CARTULINA QUE ILUMINA”
MATERIAL:
Clara de huevo
Refresco de fruta
Almíbar
Agua con sal
Agua con azúcar
5 vasos de vidrio
Linterna pequeña y potente
Cartulina negra
PROCEDIMIENTO:
Los vasos bien limpios, llénelos con los diferentes líquidos. Ponga la cartulina negra como fondo e ilumine con la linterna y obsérvelos.
¿Cómo se ve la cartulina?
Clasifique los líquidos en soluciones y coloides.
EXPLICACIÓN:
El rayo de luz pasa a través de una solución sin dispersarse, pero el rayo se dispersa cuando pasa a través de un coloide.
Los coloides son mezclas de dos fases de materia. Sus partículas son más grandes que en las soluciones, pero más chicas que en una suspensión, no pueden verse ni en el microscopio más potente. Son mezclas estables que no se separan espontáneamente.
MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS,
CAMBIO FÍSICO
"ENTRE MEZCLAS"
MATERIAL:
1 tubo de ensaye de 16 x 150 mm
1 colorante vegetal
Agua
Aceite comestible
PROCEDIMIENTO:
En un tubo de ensayo agregue la mitad de agua y una gota de colorante vegetal y agite. Después de agitar, agregue aceite comestible en el mismo tubo y observe.
La disolución del colorante en el agua es un fenómeno ¿Físico o químico? ¿El agregar aceite al agua constituye un fenómeno físico o químico?
La mezcla de colorante y agua es un sistema ¿Homogéneo o heterogéneo? ¿Y la mezcla de agua con el aceite?
EXPLICACIÓN:
La unión del colorante y agua es un fenómeno físico porque tanto el colorante como el agua antes y después del proceso conservan sus propiedades físicas y químicas. Esta unión se caracteriza por ser una mezcla homogénea.
En el caso del agua y el aceite es más evidente que se trata de un fenómeno físico ya que ambas sustancias coexisten de manera independiente conservando todas sus propiedades sin cambio alguno, lo que se conoce como mezcla heterogénea.
MÉTODOS DE SEPARACIÓN DE MEZCLAS (DESTILACIÓN)
“VIBRANDO, SALTANDO Y ESCAPANDO”
MATERIALES:
Personal humano
Gis
PROCEDIMIENTO:
Se acomodan los alumnos alrededor del aula, posteriormente se procede a dibujar en el centro del aula un equipo de destilación, de forma tal que permita la movilidad de aproximadamente 14 de ellos.
Se eligen a catorce alumnos, de los cuales cinco sean mujeres, quienes representarán al agua dentro del matraz; cuatro hombres representarán al éter etílico; tres, la acetona y dos, el jabón.
Se interroga a los alumnos sobre los puntos de ebullición de las sustancias antes mencionadas, se les informa que los residuos de jabón son sólidos y que poseen un punto de ebullición alto.
A continuación cada subgrupo de alumnos procede a actuar y relatar con voz lo suficientemente fuerte para que sea escuchada por todo el grupo:
Narración del equipo que representa al agua:
“Soy el agua, soy un líquido muy preciado por el hombre, presento simpatías con muchas de las sustancias que hay en la tierra. Por esto, si me agregan algo de sal común(cloruro de sodio), luego la cubro y hago que pierda algunas propiedades físicas como es su estado sólido. Poseo cargas negativa y positiva en los extremos de mi molécula, por lo tanto mi molécula es polar y tengo la capacidad de atraer a mis compañeros más cercanos. Por ello mi parte negativa atrae a la parte positiva del sodio de la sal común”.
Narración del éter y la acetona:
“Somos el éter y la acetona, nos dicen que somos moléculas hidrofílicas porque en griego significa que amamos el agua, presentamos atracción por ella, esto es, nos “perdemos entre sus moléculas”.
“Cuando aumenta la temperatura todos nosotros sentimos que nuestras moléculas se excitan, se incrementa el movimiento de vibración, incluso podemos desplazarnos de un lugar a otro, como está sucediendo en estos momentos que empezamos a sentir un poco más de calor. Siento calor, mucho calor, como en otras ocasiones, pero no el suficiente como para poder desplazarme por todo el recipiente”.
Narración del éter:
“El éter lo escucha y le dice: pero yo que soy sensible al calor, creo que si mis cálculos no me engañan, la temperatura debe estar cerca de los 30 ºC y como mi punto de ebullición es de 34ºC, el calor aumenta, presiento que ya es hora de irme, de desplazarme, dejar este encierro, quiero expandirme en el universo, ser parte de él, ojalá y no me vuelvan a cambiar de estado, me gusta más el gaseoso. Adiós compañeros, ¡acetona!, ¡agua!, !jabón!, llegó la hora de partir”.
Narración de la acetona:
“No te preocupes luego te alcanzo, si no lo sabes, mi estructura me permite tener propiedades físicas cercanas a la tuyas. Por si no lo recuerdas, somos primos hermanos, así que luego te alcanzo; ya empiezo a tener más movimiento. Si esto es así, la temperatura debe estar acercándose a los 50 ºC y mi punto de ebullición es de 56 ºC.
Narración del agua:
Así mero, yo apenas siento un sabroso calor ¡Estoy caliente! pero aun no hiervo de ganas para salir a buscar quién me quiera.
Narración de la acetona:
¡Ah! que calor, ahora sí me llegó la hora de partir. ¡Yo!, ya no podré en mi siguiente estado limpiar más esmaltes de uñas, ¡nos vemos pronto! Ahí los dejo con su compañero el jabón Ariel o no sé cuál, lo que sí sé es que juntos son ustedes también muy queridos; no obstante, su abuso ha hecho daño a la vida, a la naturaleza, por ello ¡No te vanaglories amigo jabón! Muévete con cuidado y sin malicia, recuerda que ¡No nada más con jabón, se quitan las manchas!
Narración del agua:
¡Ah! ¡Ah! que calorcito, parece que ahora sí me llego la hora. De seguro la temperatura está por encima de los noventa ªC, mi estructura vibra como coche desafinado, ni modo amigo jabón, yo también me voy, lo siento porque te quedas solo, pero no te preocupes, ya alguien te necesitará y vendrá por ti.
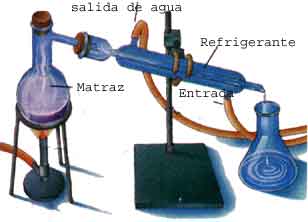
EXPLICACIÓN:
Se busca con este tipo de prácticas, incentivar al grupo hacia una mayor comunicación e interacción. Que a través de una actividad lúdica, el alumno comprenda el proceso de destilación y el comportamiento que presentan las moléculas con el aumento de la temperatura.
Efectos del hielo seco (Un material que se sublima)
LA SUBLIMACIÓN (del latín sublimāre) o volatilización es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Se puede llamar de la misma forma al proceso inverso, el paso directo del estado gaseoso al estado sólido, pero es más apropiado referirse a esa transición como sublimación inversa. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
SUBLIMACIÓN (SEPARACIÓN DE MEZCLAS) Cambio de una sustancia del estado sólido al vapor sin pasar por el estado líquido. Algunas de las moléculas de un sólido pueden vibrar muy rápidamente, vencer las fuerzas de cohesión y escapar como moléculas gaseosas al espacio libre. Inversamente, al chocar estas moléculas gaseosas contra la superficie del sólido, pueden quedar retenidas, condensándose el vapor. El equilibrio que tiene lugar cuando la velocidad de sublimación y la de condensación son iguales se caracteriza por una presión de vapor que depende de la naturaleza del sólido y de la temperatura. Progresiva: gas - solido Regresiva: solido – gas Aplicación industrial: medicina, fotografía y fabricación de tintes y agentes oxidantes.
El más común para ilustrar sublimación es a través de hielo seco, que es el nombre común que se le da al CO2 congelado. Cuando el hielo seco se expone al aire, éste se comienza a sublimar, o a convertirse en vapor. Esto le pasa al hielo seco porque a temperatura ambiente el gas congelado prefiere ser gas y no sólido congelado.
El fenómeno de sublimación regresiva o inversa (deposición) Es el proceso inverso a la sublimación progresiva, es decir, el paso directo de gas a sólido. Por ejemplo, cuando se producen vapores al calentarse cristales de yodo y luego se pone sobre ellos un objeto que está muy frío; entonces, los vapores se transformarán nuevamente en cristales de yodo. Históricamente la palabra sublimado se refirió a las sustancias formadas por deposición a partir de «vapores» (gases), como el «sublimado corrosivo», cloruro mercúrico, formado por alteración de los calomelanos cristalizado obtenido durante las operaciones alquímicas.
Cualquier sustancia pura puede sublimarse, esto debido a condiciones de presiones superiores y temperaturas inferiores a la que se produce dicha transición. En la naturaleza la sublimación inversa se observa en la formación de la nieve o de la escarcha. Las partículas partiendo de las cuales se produce la acreción o acrecimiento planetario, se forman por sublimación inversa a partir de compuestos en estado gaseoso originados en supernovas.
Este proceso también es conocido como deposición.
http://es.wikipedia.org/wiki/Sublimaci%C3%B3n
LA SUBLIMACIÓN: OTRO MÉTODO DE SEPARACIÓN DE MEZCLAS
OTROS MÉTODOS PARA SEPARAR MEZCLAS

La extracción es un procedimiento de separación de una sustancia que puede disolverse en dos disolventes no miscibles entre sí, con distinto grado de solubilidad y que están en contacto a través de una interfase. La relación de las concentraciones de dicha sustancia en cada uno de los disolventes, a una temperatura determinada, es constante La centrifugación es un método por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una centrifugadora, la cual imprime a la mezcla un movimiento rotatorio con una fuerza de mayor intensidad que la gravedad, provocando la sedimentación del sólido o de las partículas de mayor densidad.
La Cromatografía es una técnica que permite separar los componentes de una mezcla haciéndola pasar a través de un medio adsorbente (adhesión a una superficie). Una de las más sencillas es la cromatografía en papel que emplea como medio adsorbente papel filtro y como solvente un líquido.Los distintos componentes se separan debido a que cada uno de ellos manifiesta diferentes afinidades por el papel filtro o por el disolvente.
El Tamizado es un método de separación, es uno de los más sencillos y consiste en hacer pasar una mezcla de sólidos, de distinto tamaño, a través de un tamiz. Los granos más pequeños atraviesan el tamiz y los más grandes son retenidos.
La Cristalización es el método no solo de separación de sólidos, sino de purificación de sustancias; se basa en la diferencia de los puntos de solidificación de los componentes de la mezcla. El soluble impuro se disuelve en un solvente adecuado hasta saturación, en cliente; se deja enfriar la solución lentamente para que se produzca la cristalización. Se separa los cristales por filtración, se lavan con solvente puro y se dejan secar si algunas impurezas cristalizan con la sustancia problema, se recurre a una recristalización.
jueves, 1 de enero de 2009
EVAPORACIÓN
Evaporación. En este método la mezcla es sometida a calentamiento para extraer el líquido que contiene, y sólo queda el sólido en el recipiente del experimento. A modo de ejemplo, se puede preparar una solución de agua con sal y calentar la mezcla, con lo cual se evaporará el agua y quedará solamente la sal. ¿Cuántas veces has observado este fenómeno al caminar entre las rocas de una playa, ver los depósitos de sal y las rocas secas?
Suscribirse a:
Entradas (Atom)
